
Modèle
Axial / Extraxial
Tout d'abord un grand merci à Didier Marchand de l'Université de Bourgogne, dont l'intérêt pour les Echinodermes me permet aujourd'hui de vous présenter l'article ci-dessous. Reproduit dans son intégralité, précisons toutefois que certaines parties ont été remaniées récemment (2000) au travers d'un article paru dans Paleobiology, 26(4), 2000, pp.529-555. Cela n'enlève rien à l'intérêt du crible EAT vis à vis de l'inventaire "à la Prévert" que sont les différentes classes d'échinodermes (tout au moins au travers du prisme déformant de la symétrie pentaradiaire). Nul doute que cette théorie s'affirmera, que son caractère interprétatif la consacrera et que certaines hésitations dans la phylogénie vont disparaître. En tous cas, personnellement, je lui souhaite longue vie et y adhère totalement. Merci donc également (et tout particulièrement, d'ailleurs) aux auteurs.
Vos réactions, vos questions, vos critiques seront les bienvenues et je me chargerai de les faire suivre aux auteurs ainsi qu'à D. Marchand. Le but de cette publication dans Echinologia étant également de "sonder" le ressenti sur cette théorie dans le monde des Amateurs. Donc n'hésitez pas, cliquez sur la petite icône ci-dessous pour nous faire part de vos impressions. A noter que vos commentaires seront transmis à titre anonyme (sauf à ce qu'il s'agisse de questions).
Bonne lecture !
Comprendre les échinodermes : la contribution du modèle extraxial - axial
Par Bruno DAVID(1) & Rich MOOI(2)
Mots clés : Echinodermes, Anatomie, Squelette, Homologie, Phylogénie, Symétrie
Résumé : Un nouveau système d'homologies du squelette des échinodermes est présenté. Le modèle extraxial-axial (E.A.T. pour extraxial-axial theory) permet de reconnaître deux parties majeures dans la paroi du corps : (1) les éléments axiaux disposés selon une règle stricte et associés au système aquifère ; (2) les éléments extraxiaux. Les données de l'embryologie confirment que les éléments axiaux et extraxiaux sont d'origine différente. Le pouvoir explicatif du modèle EAT est testé pour décrypter l'architecture de morphologies extrêmes ou de cas tératologiques. Plusieurs implications majeures du modèle EAT sur notre interprétation du phylum et de son évolution sont analysées. (1) Les interambulacres des échinides ne sont pas homologues de ceux des autres échinodermes et l'oursin est sans doute l'échinoderme le plus atypique. (2) Les ceintures marginales des astérides et les anneaux des édrioastéroïdes ne sont pas homologues. (3) Il existe différents types de "bras" ; ceux des crinoïdes et des astérides étant homologues, le groupe des pelmatozoiaires n'a plus de raison d'être. (4) Les stylophores (cornutes et mitrates) ne sont pas des formes primitives, mais apparaissent proches des crinoÏdes. (5) La pentamérie est une caractéristique qui se surimpose à une organisation fondamentalement linéaire, comme chez la plupart des organismes.
English people, please click on the button below for abidged version
Introduction
Faut-il reconsidérer notre conception des Echinodermata ?
Il semble aujourd'hui acquis que les échinodermes occupent une position particulière dans la diversité du vivant. Ce sont des organismes fondamentalement pentaradiés, morphologiquement très démarqués de tous les autres groupes zoologiques et, de fait, faciles à reconnaître car il présentent des caractères très dérivés (apomorphies). Parmi ces derniers : un squelette calcitique organisé en un réseau tridimensionnel, le stéréome ; un système aquifère qui est un coelome tubulaire ; et une symétric rayonnée d'ordre 5. Le phylum présente une grande diversité interne qui s'exprime à travers une multitude de plans d'organisation (Ubaghs [1967 a] reconnaît 21 classes bien distinctes dont 5 ont des représentants actuels). Il est également admis que les stades larvaires, très différents des formes adultes, sont les seuls permettant de retracer les affinités des échinodermes avec d'autres groupes de deutérostomes. Ces conceptions, exposées dans tous les manuels [Brusca & Brusca, 1990 ; Enay, 1993] et universellement enseignées, sont bien établies. Pourtant, plusieurs signes font pressentir que le modèle actuel de plan d'organisation des échinodermes (modèle pentaradié, fig.1a), construit principalement autour des oursins et des étoiles de mer, n'est pas pleinement satisfaisant.
1 - Selon ce modèle, les échinodermes ne présentent aucune trace évidente de la segmentation longitudinale que l'on pourrait attendre chez un phylum qui partage des affinités avec les cordés. Il fait des échinodermes des organismes très à part alors même que des gènes homéobox, identiques à ceux reconnus chez les autres phylums, sont identifiés [Lowe & Wray, 1997].
2 - Un autre élément surprenant est que la structure bilatérale des larves est rarement connectée de manière claire avec celle, radiale, des adultes à travers un schéma d'homologies bien établies. Le désarroi face à une telle situation a abouti à invoquer une réponse aussi aberrante que l'existence d'un génome larvaire distinct de celui des adultes [Williamson, 1992], une hypothèse mal argumentée et rejetée depuis [Hart, 1996].
3 - Ce modèle échoue à intégrer la diversité des 21 classes dans un schéma phylétique claire. Pourtant, depuis l'introduction de la démarche cladistique, de nombreuses tentatives de clarification des relations de parenté entre les classes d'échinodermes ont été proposées [Paul & Smith, 1984 ; Smith, 1984a ; Matsumura & Shigei, 1988 ; Smiley, 1988 ; Smith, 1988 ; Strathmann, 1988 ; Marshall, 1994 ; Pearse & Pearse, 1994 ; Littlewood et al., 1997 ; Sumrall, 1997] à partir de données morphologiques, biochimiques, ou moléculaires de plus en plus abondantes. Si ces tentatives n'aboutissent pas à un schéma consensuel des parentés, elles prouvent en revanche que l'inflation des données (71 caractères larvaires et adultes et 531 sites moléculaires pour Littlewood et al., 1997 ; 146 caractères morphologiques pour Sumrall et Sprinkle, 1998) ne résoudra pas la question de la phylogenèse des échinodermes. Les données moléculaires, qui ne nous renseignent que sur les 5 classes encore représentées actuellement, se heurtent au fait que les divergences entre ces classes sont trop anciennes et se sont produites dans un temps relativement trop court pour que les molécules les hiérarchisent clairement [Smith, 1992]. Les données morphologiques sont obérées par l'utilisation répétée de caractères plus fondés sur des ressemblances superficielles (analogies) que sur de véritables homologies.
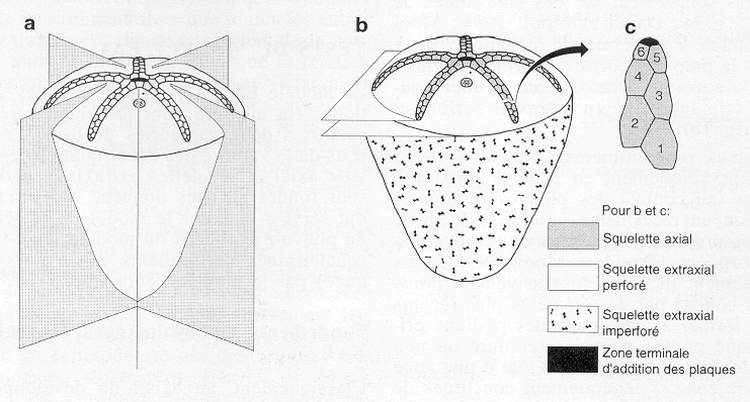
Fig. 1 - Interprétations de l'organisation somatique chez un échinoderme standardisé. a : le modèle pentaradié classique. b : le modèle EAT. c : Mise en place d'éléments squelettiques axiaux selon l'OPR.
Fig. 1 - Traditional model of somatic organization in a generalized echinoderm and reinterpretation according to the EAT. a : the pentaradial model. b : the EAT. c : the OPR as exemplified by the tip of a generalized ambulacrum.
Les échecs du modèle pentaradié s'expliquent essentiellement par l'absence d'un système d'homologies embrassant toutes les classes d'échinodermes dans un schéma cohérent, alors que de tels schémas existent depuis longtemps pour la plupart des autres phylums. Par exemple, le crâne, les ceintures scapulaire et pelvienne, ou l'axe vertébral sont rigoureusement identifiables dans toutes les classes de vertébrés. Chez les échinodermes, cette lacune d'homologies pertinentes incombe à deux raisons principales. (1) Depuis bientôt 200 ans, l'accent a été mis sur les différences entre les plans d'organisation des classes et non pas sur leurs similitudes. Cette situation transparaît dans la disparité excessive de la terminologie : ainsi, entre un crinoïde et un échinides, pratiquement pas une plaque du squelette ne porte le même nom ; il existe aussi pléthore de noms pour désigner les structures larvaires dans les différentes classes [Hyman, 1955]. (2) Lorsque des homologies sont évoquées, elles se fondent fréquemment sur des similitudes de position : ventral, oral, apical, interradial... et non pas sur des critères d'origine commune. En corollaire, le même terme est parfois utilisé pour désigner des structures différentes.
L'accumulation d'informations dans un cadre pré-établi (en l'occurence celui du modèle pentaradié associé à une terminologie qui masque la réalité des homologies) n'est jamais féconde [Gould, 1980]. Récemment, nous avons développé un nouveau système d'homologies du squelette des échinodermes (modèle EAT pour extraxial-axial theory) qui reconsidère les fondements du modèle pentaradié. L'objectif de cet article est, après un bref rappel du modèle EAT, de le tester, puis d'en explorer certaines implications sur la paléontologie des échinodermes et sur la compréhension de leur évolution.
Le modèle E.A.T.
Le modèle EAT est fondé sur l'organisation architecturale des éléments du squelette, associée aux grands traits de leur ontogenèse, et non pas simplement sur des similitudes de position [Mooi et al., 1994 ; David & Mooi, 1996 ; Mooi & David, 1997]. Le modèle EAT permet de reconnaître deux parties majeures dans la paroi du corps d'un échinoderme : le squelette axial et le squelette extraxial, ce dernier pouvant, le cas échéant, être subdivisé en extraxial perforé et extraxial imperforé (fig. 1b).
- Les éléments axiaux sont intimement liés au système aquifère. Ils se mettent uniquement en place à proximité des podions primaires (au contact des plaques terminales chez les oursins) selon un mécanisme strict l'OPR (pour ocular plate rule). Les premiers éléments axiaux apparaissent avant la métamorphose [David & Mooi, 1996], puis au cours du développement ils sont progressivement poussés en direction de la bouche par des éléments plus récents qui continuent de se former au voisinage des podions primaires (fig.1c). Chaque podion primaire (entouré ou non d'une plaque terminale) se trouve ainsi à la tête d'une zone de croissance ("growth zone") généralement constituée de 2 colonnes de plaques régulièrement disposées selon une architecture bisériée, avec des plaques en position alternante. Dans sa totalité, le squelette axial d'un échinoderme est donc constitué de 5 zones de croissance radiales qui convergent vers la bouche.
- Le squelette extraxial rassemble tous les éléments qui ne sont pas liés au système aquifère et dont la mise en place ne suit pas la règle de l'OPR. Les éléments extraxiaux peuvent se former à divers endroits du corps et, en conséquence, ils ne sont généralement pas disposés selon une architecture organisée, mais constituent une mosaïque isotrope de plaques. Le squelette extraxial laisse le passage à de nombreuses ouvertures anatomiques : épispires, coelomopores, gonopores, anus et hydropores. Le regroupement de ces ouvertures dans une partie précise du squelette extraxial permet de distinguer un squelette extraxial perforé d'un squelette extraxial imperforé.
Le modèle EAT propose donc un schéma d'homologies entre les grandes parties du corps des échinodermes qui correspond à une organisation fondamentalement sériée et qui ne privilégie pas la structure rayonnée (comparer les figures 1a et 1b). L'importance relative des parties axiale et extraxiale varie d'une classe à l'autre et l'étonnante diversité des échinodermes adultes peut alors être rapportée à un changement d'équilibre entre les deux composantes de la paroi du corps. Le squelette extraxial prédomine largement dans les groupes les plus anciens. Ainsi, l'essentiel de la thèque de Camptostroma est constitué de squelette extraxial imperforé, tandis que le squelette axial est restreint aux ambulacres imbriqués sur la face orale et que le squelette extraxial perforé correspond aux secteurs dits "interambulacraires" (fig.2a). Chez les cystoïdes, le squelette extraxial imperforé s'organise en une tige, le squelette extraxial perforé et le squelette axial constituant ensemble le calice (fig.2b). Les étoiles de mer sont dépourvues de squelette extraxial imperforé, le squelette axial a pris une plus grande place sur la face orale (plaques ambulacraires et adambulacraires), mais la majeure partie de leur corps est faite de squelette extraxial perforé (fig.2c). Le test des oursins est presque exclusivement axial et le squelette extraxial est réduit aux plaques génitales et aux plaques des 5 zones de croissance axiales jointives, chacune comprenant un ambulacre (2 rangées de plaques) encadré de chaque côté par une colonne de plaques interambulacraires (fig.2d). Il est intéressant de signaler ici que nos investigations sur les oursins nous ont amenés à redécouvrir que Jackson avait parfaitement perçu dès 1912, mais que cet aspect de son travail a été totalement ignoré (oublié ?) jusqu'à présent.
Tests du modèle E.A.T.
Le modèle EAT, déjà justifié par des arguments ontogénétiques (la manière dont les plaques se forment) peut être soumis à deux catégories de tests. Les premiers sont des tests de la validité des démarcations envisagées entre squelette axial et squelettes extraxiaux perforé et imperforé. Ils sont fondés sur des données indépendantes de celles qui ont servi à élaborer le modèle. Les seconds sont des tests du pouvoir explicatif du modèle vis-à-vis de configurations squelettiques particulières jusqu'alors mal ou pas expliquées par le modèle pentaradié.
Fondements embryologiques et génétiques du modèle EAT
Classiquement, au début du développement d'un échinoderme, la cavité coelomique initiale se subdivise en un certain nombre de poches plus ou moins indépendantes (fig.3a). Parmi elles, deux (les somatocoeles droit et gauche) occupent rapidement une place importante. Une troisième cavité (l'hydrocoele) se développe en entourant la bouche, puis en produisant 5 lobes primordiaux - qui deviendront les 5 podions primaires - et qui s'étireront ensuite pour élaborer les 5 canaux ambulacraires. Dans la dernière partie de la vie larvaire, l'ectoderme larvaire, les lobes primordiaux de l'hydrocoele, et éventuellement des processus issus du somatocoele gauche interagissent pour former le rudiment. La métamorphose correspond ensuite à un déploiement du rudiment vers l'extérieur et à une résorption plus ou moins importante des tissus larvaires (fig.3b). Le jeune échinoderme est ainsi constitué d'un certain nombre d'éléments hérités de la partie strictement larvaire (corps de la larve à l'exclusion du rudiment) et d'éléments formés dans le rudiment. Chez l'oursin Paracentrotus lividus, Gosselin & Jangoux [1998] montrent que les plaques génitales se forment en dehors du rudiment alors que toutes les autres plaques du test (terminales et premières plaques de la couronne) apparaissent dans le rudiment. Bien que la relation entre les plaques de l'appareil apical et les spicules larvaires pré-existants ne soit pas univoque (deux plaques termines [axial] et trois plaques génitales [=extraxial] se minéralisent en connexion avec des spicules larvaires), il existe une dualité nette entre éléments axiaux et extraxiaux. Au niveau du squelette, on constate ainsi que tous les éléments extraxiaux se forment dans la partie strictement larvaire et sont liés aux somatocoeles droit et gauche alors que tous les éléments axiaux, étroitement liés à l'hydrocoele, dérivent du rudiment et de son expansion. La limite entre les parties extraxiale et axiale du corps, coïncide donc exactement avec la limite entre éléments hérités de la partie strictement larvaire et éléments issus du rudiment. Les parties extraxiale et axiale du corps d'un échinoderme ont des origines embryologique radicalement différentes [David & Mooi, 1996]. Par ailleurs, il est vraisemblable que les parties extraxiale imperforée et extraxiale perforée ont également des origines embryologiques distinctes (par exemple seul le somatocoele droit est en contact avec le squelette extraxial imperforé), mais les investigations complémentaires seront nécessaires pour en déterminer l'origine précise.
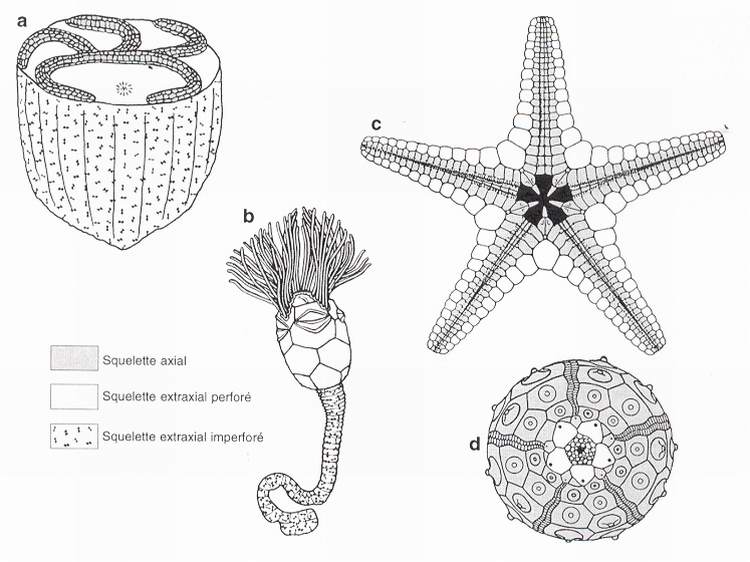
Fig. 2 - Principaux types de squelette chez les échinodermes. a : Camptostroma, vue orale oblique (épispires omises). b : cystoïde, vue de profil [d'après Kesling, 1967]. c : astéride, vue orale [d'après Spencer & Wright, 1966]. d : echinide, vue apicale [d'après Boolootian, 1966].
Fig. 2 - Distributions of major skeletal types in a diversity of echinoderm morphotypes. a : Camptostroma, oral oblique view (epispires omitted). b : cystoid, side view [after Kesling, 1967]. c : asteroid, oral view [after Spencer & Wright, 1966]. d : echinoid, aboral view [after Boolootian, 1966].
Les 5 classes actuelles, pour lesquelles on dispose de données embryologiques, suivent le même modèle de développement et les différences majeures observées entre elles peuvent, pour l'essentiel, être rapportées à l'importance plus ou moins grande prise par le rudiment. D'une manière générale, l'ampleur du déploiement des structures issues du rudiment détermine l'importance de la partie axiale du corps de l'adulte. Les échinides élaborent le rudiment le plus complexe et le plus largement déployé (évagination de plus de 250°) ; leur corps est presque exclusivement axial (fig.2d). Chez les astérides, le développement du rudiment est plus simple et équivaut à une évagination de 180° ; leur architecture traduit un partage équilibré entre éléments axiaux et extraxiaux (fig.2c).
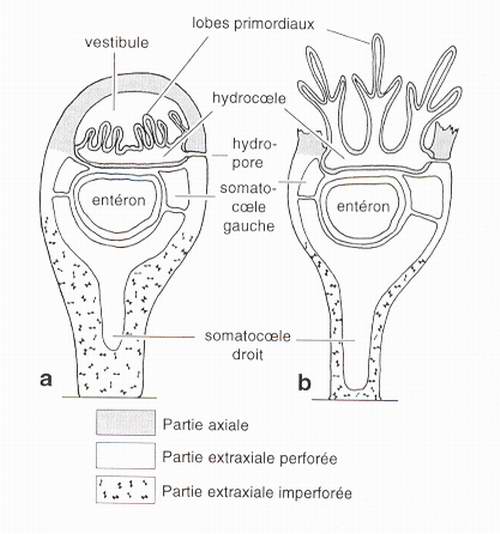
Fig.3 - Disposition des coelomes dans les premiers stades de l'ontogenèse et relation avec le modèle EAT. Sections d'un stade larvaire de crinoïde. a: stade atteint juste après la fixation de la tige sur un substrat ; b : stade de déploiement du rudiment.
Fig.3 - Arrangement of coeloms and its relationship to the EAT in early ontogeny, as exemplified by sections through a larval crinoid. a : stage of development just after settlement and fixation of the stem to the substrate. b : slightly later stage of development just after eversion of the rudiment.
Une des prédictions du modèle EAT est que, chez les holothuries, seule la région comprise dans le cercle des tentacules péribuccaux est axiale. Ceci implique que les tentacules péribuccaux des hologhuries soient homologues des canaux ambulacraires radiaires des autres échinodermes [David & Mooi, 1996]. Des résultats récents [Lowe & Wray, 1997] acquis sur les gènes homéobox contrôlant le développement (gènes orthodenticle et distal-less) viennent corroborer cette hypothèse et donc conforter le modèle EAT.
La démarcation principale envisagée par le modèle EAT (extraxial/axial) trouve donc une double justification embryologique et génétique alors qu'aucune donnée ne justifie les coupures radiales telles que supposées par le modèle pentaradié.
Pouvoir explicatif du modèle EAT
Le modèle EAT témoigne de sa pertinence lorsqu'il permet de clarifier l'interprétation de groupes à l'architecture bizarre. Parmi eux, la classe des stylophores (cornutes et mitrates) est celui qui a donné lieu aux plus vives polémiques. Les stylophores sont des échinodermes paléozoïques constitués d'une thèque aplatie prolongée par un appendice, l'aulacophore (fig.4). Aucune symétrie rayonnante, ni aucune symétrie bilatérale nette ne peut être reconnue sur ces animaux et une hypothèse en vogue depuis quelques années et largement généralisée [Boardman et al., 1987 ; Brusca & Brusca, 1990 ; Enay, 1993] consiste à exclure certains d'entre eux des échinodermes et à les considérer comme les ancêtres des cordés, l'aulacophore étant alors interprété comme un appendice caudal [Jefferies, 1981 ; 1986 ; 1997 ; Cripps, 1991 ; Woods & Jefferies, 1992 ; Beisswenger, 1994]. Un taxon particulier, les Calcichordata, a même été créé pour les désigner [Jefferies, 1967]. D'autres auteurs [Ubaghs, 1967b ; Paul & Smith, 1984 ; Parsley, 1991 ; 1997 ; Peterson, 1995 ; Lefebvre et al., 1998] ont en revanche maintenu tous les stylophores dans les échinodermes. Toutefois, l'absence de symétrie pentaradiée et leur architecture étrange ont généralement contribué à les considérer comme des échinodermes primitifs [Smith, 1984a ; 1988]. Appliqué aux stylophores, le modèle pentaradié souligne l'absence de caractères partagés avec les autres groupes (synapomorphies) et la position des stylophores est ipso facto forcée à la base des arbres phylétiques par la démarche cladistique. Le manque de précision des documents stratigraphiques ne permet pas d'avancer d'autres hypothèses.
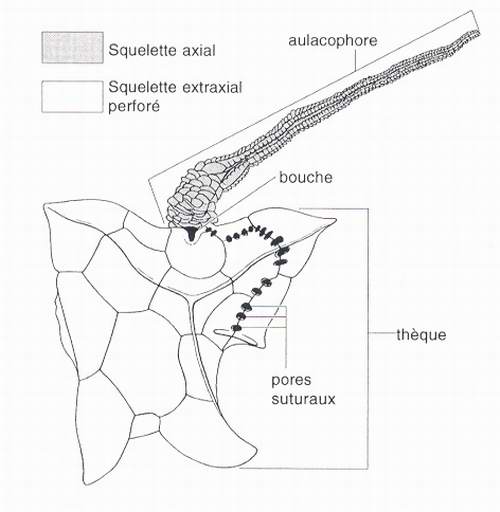
Fig.4 - Stylophore [d'après Ubaghs, 1967b] interprété selon le modèle EAT.
Fig.4 - Stylophoran [after Ubaghs, 1967b] as interpreted by the EAT.
A la lumière du modèle EAT, il devient possible de comprendre les stylophores comme des échinodermes chez lesquels le squelette axial est réduit à une seule zone de croissance localisée sur la face orale de l'aulacophore, tout le reste de l'organisme étant en squelette extraxial (fig.4). Le modèle EAT révèle que la structure de l'aulacophore rappelle fortement celle d'un bras (voir ci-dessous, paragraphe IV). Cette interprétation conduit à envisager les stylophores, non plus comme des formes primitives, mais au contraire comme des formes très dérivées, vraisemblablement apparentées aux crinoïdes.
Les concepts d'OPR et de zone de croissance, à la base du modèle EAT, peuvent être appliqués pour interpréter les architectures apicales apparemment anarchiques de certains oursins, qu'elles appartiennent à des taxons très dérivés ou qu'elles correspondent à des variations individuelles d'origine tératologique. Par exemple, A. Agassiz [1904] a eu recours à des plaques surnuméraires (notées X) pour expliquer la disjonction entre parties antérieure et postérieur de l'appareil apical de l'oursin irrégulier abyssal Plexechinus cinctus. L'utilisation de l'OPR permet d'assigner sans difficulté chacune des plaques X à l'une des 5 zones de croissance comme étant les deux plaques génitales postérieures dépourvues de gonopore [Mooi & David, 1997]. Certaines espèces d'échinides réguliers de l'Antarctique présentent une modification spectaculaire de leur système génital [Koehler, 1912]. Les conduits génitaux qui partent des gonades, au lieu de remonter vers l'appareil apical pour desservir les plaques génitales, descendent à l'intérieur du test et s'ouvrent à mi-hauteur de la couronne dans les sutures médianes des interambulacres. A première vue, ceci semble aller à l'encontre du modèle EAT qui associe les gonopores au squelette extraxial (fig.2d). Mais cette impression est contredite par le concept de zone de croissance qui atteste que les gonopores, migrant le long des sutures médianes des interambulacres, sont en réalité comprimés entre des unités axiales et conservent de fait une position extraxiale.
Les mêmes concepts trouvent une validation dans les variations individuelles qui s'écartent de la pentamérie. Chez les spécimens tétramériques, les éléments manquants correspondent généralement à une zone de croissance, c'est à dire à un ambulacre encadré de deux demis interambulacres (ce fait avait déjà été constaté par L. Agassiz en 1841)Il est logique de considérer que la tétramérie parfaite est due à l'absence d'un des 5 lobes primordiaux de l'hydrocoele et donc à l'absence d'un podion primaire et de sa plaque terminale, lieu de mise en place des 4 colonnes de plaques d'une zone de croissance. A l'inverse les cas d'hexamérie sont toujours liés à l'existence d'une plaque terminale supplémentaire [Jackson, 1912].
Implications du modèle EAT
Le modèle EAT constitue une puissante clef de lecture pour déchiffrer le détail des homologies entre les classes d'échinodermes, y compris pour les formes les plus étranges. En aval de ce nouveau schéma des homologies, il conduit à reconsidérer en profondeur certains des grands traits de l'histoire et de l'origine du phylum. L'objectif de cet article n'est pas ici d'être exhaustif, mais simplement de souligner quelques uns des changements d'interprétation des plus notables.
Interambulacres
Du collège à l'université, toute description du test d'un oursin le représente comme constitué de 5 ambulacres alternant avec 5 interambulacres. Toute comparaison avec une étoile de mer souligne l'équivalence entre interambulacres de l'oursin et zones interradiales de l'étoile de mer. Si la comparaison est étendue à un édrioastéroïde paléozoïque, le même terme "interambulacre" est utilisé pour désigner les zones entre les ambulacres. D'une manière générale, le modèle pentaradié amène à décrire tous les échinodermes chez cette symétrie est reconnaissable comme constitués d'ambulacres et d'interambulacres.. Depuis plus de cent ans cette manière de présenter les échinodermes a ancré dans nos esprits l'idée qu'ambulacres et interambulacres étaient homologues d'un groupe à l'autre, alors même que ces mots ne font référence qu'à des positions relatives.
Le mécanisme de l'OPR et la notion de zone de croissance permettent de tracer aisément la limite entre éléments axiaux et extraxiaux chez presque toutes les classes d'échinodermes. Les zones interradiales des formes paléozoïques (édrioastéroïdes, cystoïdes, blastoïdes...) comme celles des astérides sont constitués d'éléments extraxiaux qui viennent remplir l'espace séparant les zones de croissance non jointives de ces animaux (fig.5a). En revanche, nous avons indiqué ci-dessus que les interambulacres des échinides étaient axiaux et qu'ils correspondaient en fait à des entités composites, constituées de deux moitiés issues chacune de deux zones de croissance jointives (fig.5b).
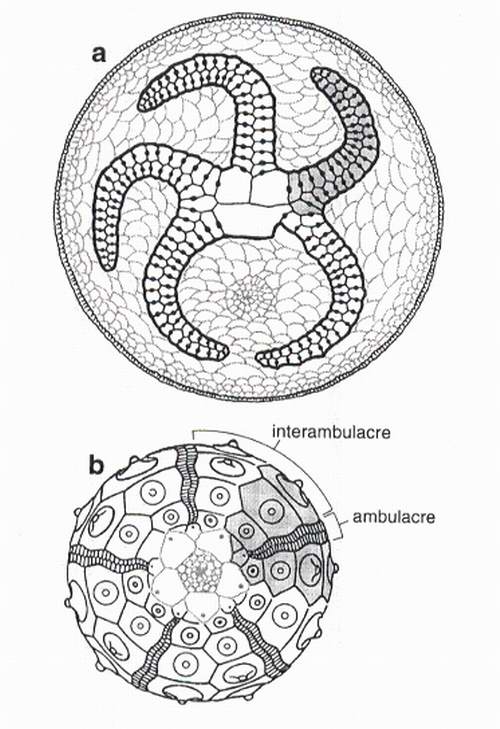
Fig.5 - Relation entre interambulacres et zones de croissance (une est grisée) selon le modèle EAT. a : edrioasteroïde, vue orale. b : echinide, vue apicale [d'après Boolootian, 1966].
Fig.5 - Interambulacra and axial growth zones (shaded) according to the EAT. a : edrioasteroid, oral view. b : echinoid, aboral view [after Boolootian, 1966].
Les homologies communément acceptées entre les interambulacres des échinides et les zones interradiales des astérides [Smith, 1984b] ou des formes paléozoïques [Paul & Smith, 1984] sont donc fausses. En toute rigueur, le terme interambulacre devrait être réservé aux seuls échinides et proscrit pour désigner les secteurs extraxiaux intercalés entre des zones axiales, pour lesquels on doit parler de zones interradiales. 'emploi de deux termes différents apparaît obligatoire puisque les structures ne sont pas homologues et correspondent à des évènements phylogénétiques distincts.
Ceintures et anneaux marginaux
Les édrioastéroïdes possèdent souvent un anneau, constitué d'une ou de plusieurs rangées de plaques de plus grande taille qui ceinturent la zone de la thèque occupée par les ambulacres (fig.6a). Par ailleurs, de nombreuses étoiles de mer présentent à la limite entre les faces orale et aborale une double ceinture de plaques, souvent de plus grande taille, respectivement les plaques inféro- et supéromarginales (fig.6b). Ces structures occupent exactement la même position relative chez les édrioastéroïdes et les astérides : elles marquent la frontière entre faces orale et aborale et jouxtent les extrémités distales des ambulacres. Cette grande similitude a tout naturellement conduit à considérer anneau et ceinture marginale comme homologues et à les utiliser comme une synapomorphie dans les schémas phylétiques faisant dériver les astérides s'un sous-ensemble d'édrioastéroïdes [Smith, 1990 ; Smith & Jell, 1990].
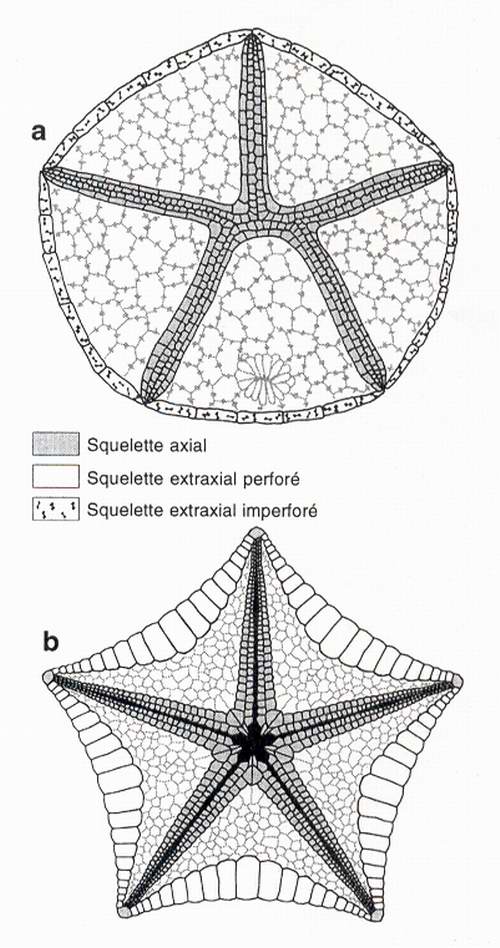
Fig. 6 - Ceintures et anneaux marginaux interprétés selon le modèle EAT. a : Stromatocystites, vue orale. b : astéride, vue orale.
Fig. 6 - Marginal rings according to the EAT. a: stromatocystitoid, oral view. b : asteroid, oral view.
Le modèle EAT révèle que le squelette extraxial perforé des édrioastéroïdes est restreint aux seuls secteurs en position interradiale. Cette interprétation est fondée sur une comparaison avec une forme primitive, Stromatocystites, chez laquelle l'ensemble du squelette extraxial perforé est aisément reconnaissable du fait de la présence de pores suturaux (ou épispires) entre les plaques (fig.6a). Dans cette configuration, l'anneau marginal de Stromatocystites et des édrioastéroïdes représente la terminaison adorale du squelette extraxial imperforé qui forme la face aborale. Chez les astérides, l'anus et la madréporite (avec les hydropores) s'ouvrent sur la face aborale qui apparaît ainsi pavée d'éléments extraxiaux perforés. La ceinture marginale d'une étoile de mer est donc une structure qui se trouve située au sein du squelette extraxial perforé (fig.6b). Cette topologie nous a conduit à l'interpréter comme appartenant au squelette extraxial perforé [Mooi et al., 1994 ; Mooi & David, 1997]. Toutefois, la disposition régulière des plaques marginales et la connexité entre nouvelles plaques qui se forment et plaques terminales n'excluent pas d'interpréter la ceinture marginale comme axiale. Mais quelle que soit l'interprétation retenue, la ceinture marginale d'une étoile de mer ne peut pas être homologue avec l'anneau marginal d'un édrioastéroïde et une étoile de mer ne peut pas être considérée comme un édrioastéroïde retourné, sa face ventrale orientée vers le substratum.
Bras et brachioles
Le corps de nombreux échinodermes comprend des digitations plus ou moins marquées et plus ou moins nombreuses. Les étoiles de mer possèdent en règle générale des bras peu nombreux et largement connectés au disque central. Les ophiures on des bras longs et fins, éventuellement subdivisés en de multiples rameaux (ophiures gorgonocéphales). Les crinoïdes déploient un panache de bras et de pinnules très ramifié. Les cystoïdes et les blastoïdes développent des brachioles. Les lépidocystoïdes peuvent avoir des bras ou des brachioles. Cet inventaire rapide de la nomenclature classique fait bien pressentir que les termes de bras, pinnule ou brachiole ont été créés sans véritable vision d'ensemble, puis entérinés par l'usage. Surmontant cette terminologie hétéroclite, plusieurs hypothèses de parentés proposées entre les principaux groupes d'échinodermes suggèrent de possibles homologies entre les différents types de digitations [Fell, 1963 ; 1965 ; Paul & Smith, 1984 ; Smith, 1984a ; 1990 ; Sumrall, 1997]. L'hypothèse de Fell regroupe tous les échinodermes possédant des bras dans deux sous-phylums : les Crinozoa et les Asterozoa (fig.7a). Curieusement, cette dichotomie n'empêche pas Fell d'insister sur la similarité de construction entre bras et brachioles des premiers et bras des seconds. Dans cette hypothèse toutes les digitations des échinodermes sont donc envisagées comme issues d'un seul évènement évolutif et donc homologues. L'hypothèse de Smith, qui est la plus communément acceptée depuis une dizaine d'années, sépare les Eleutherozoa (échinodermes libres incluant, entre autres, les astérides et les ophiures) des Permatozoa (échinodermes fixés incluant les lépidocystoïdes, cystoïdes, blastoïdes, crinoïdes). Au sein des Pelmatozoa, les Crinoidea (lépodocystoïdes pro parte, crinoïdes sensu lato) sont séparés des Cystoidea (lépidocystoïdes pro parte, cystoïdes, blastoïdes). Selon ce schéma (fig.7b), les bras des étoiles de mer et des crinoïdes ne sont pas homologues car ils ont des origines radicalement différentes. Les brachioles sont interprétés comme des structures très particulières (pieds ambulacraires calcifiés, pavés de plaques de couverture) propres aux Cystoidea. Dans cette hypothèse, les digitations des échinodermes se distribuent donc en trois catégories - brachioles, bras des astérides, bras pinnulés des crinoïdes - issues d'évènements évolutifs indépendants.
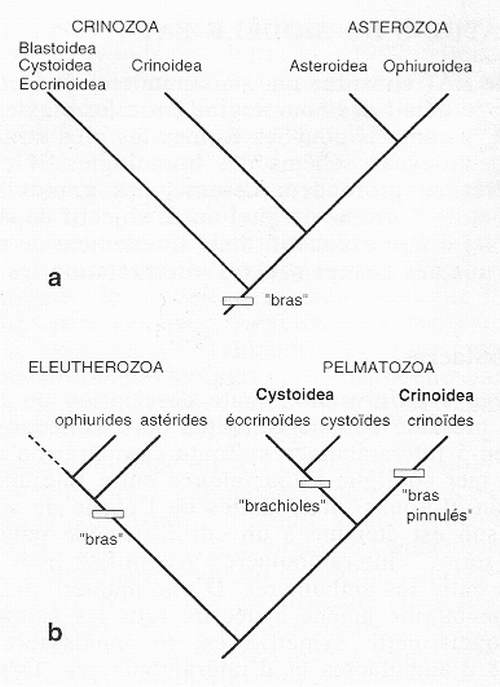
Fig. 7 - Cladogrammes des principaux groupes d'échinodermes par Fell [1963 ; 1965]. b : hypothèse de Paul & Smith [1984] et Smith [1984a].
Fig. 7 - Cladograms of the major groups of echinoderms that exhibit some form of "arms". a : translation of the hypothesis presented by Fell [1963 ; 1965]. b : hypothesis of Paul & Smith [1984] and Smith [1984a].
L'analyse architecturale, au crible du modèle EAT, des diverses digitations rencontrées dans les principaux groupes d'échinodermes démontre qu'il existe plusieurs type d'extensions brachiales. Nous avons reconnu deux types principaux qui diffèrent sensiblement des catégories admises ci-dessus dans l'hypothèse de Smith.
Bras
Les bras des astérides correspondent à des digitations qui impliquent simultanément des éléments axiaux et des éléments extraxiaux (fig.2c). Ils abritent également des extensions des trois poches coelomiques principales (hydrocoele et les deux somatocoeles droit et gauche). De tels bras correspondent donc à des étirements radiaires de l'ensemble du corps de l'animal (fig.8a). La même organisation générale se retrouve chez les ophiures et chez les crinoïdes. Chez ces derniers, les bras sont habituellement très fins et ramifiés en branches secondaires, tertiaires... jusqu'aux pinnules. Mais, jusque dans les branches ultimes, les trois coelomes sont présents. Le terme "endothecal" a même été proposé [Ubabhs, 1967a] pour souligner que les bras des crinoïdes doivent être compris comme des évaginations du calice : c'est le corps tout entier qui est digité. Chez les crinoïdes, le squelette extraxial perforé qui constitue la base des bras est représenté par les plaques brachiales qui se succèdent selon un agencement monosérié reconnaissable dans toute la hiérarchie des ramifications jusqu'aux pinnules. Le squelette axial est ordinairement très discret, réduit à quelques plaques ambulacraires sur le tegmen (zone qui entoure la bouche au coeur du calice) et à quelques minuscules plaques de couverture égrenées le long des sillons brachiaux. L'aulacophore des stylophores (fig.4) possède un agencement unisérié de plaques basales et peut donc être légitimement interprété comme un bras.
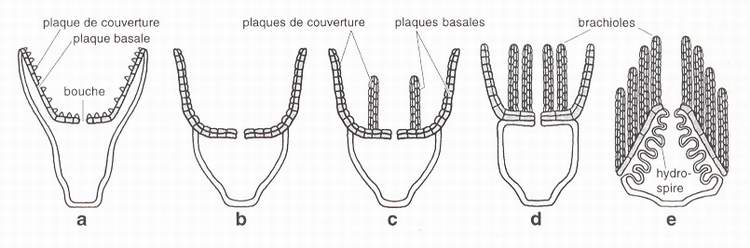
Fig. 8 - Principaux types d'extensions brachiales interprétés selon le modèle EAT, squelette axial grisé. a : bras chez une forme de type crinoïde ou astéride. b : bras axiaux chez une forme de type éocrinoïde. c : bras axiaux supportant des brachioles chez une forme de type Lepidocystis. d : bras axiaux et brachioles chez une forme de type cystoïde thombifère. e : bras axiaux et brachioles chez un blastoïde.
Fig. 8 - Major types of brachial extensions according to the EAT, axial skeleton shaded. a : arms of the crinoid or asteroid type. b : axial arms of the eocrinoid type. c : axial armes and brachioles of the Lepidocystis type. d : axial arms and brachioles of the rhombiferan cystoid type. e : axial arms and brachioles in a typical blastoid.
Bras axiaux
Certains lépidocystoïdes (Lepidocystis) et éocrinoïdes (Gogia, Nolichuckia) étendent leurs ambulacres au-delà de la thèque. Ces extensions ne concernent que le squelette axial et, selon toute vraisemblance, que l'hydrocoele (fig.8b). Nous proposons de les désigner sous le nom de bras axiaux. Les bras axiaux sont constitués de plaques basales disposées selon un agencement bisérié et mises en place selon l'OPR à partir de l'extrémité du bras. Les plaques basales bisériées supportent les canaux ambulacraires protégés par de petites plaques de couverture (bisériées ou non). Les bras axiaux sont présents dans de nombreux groupes, tous paléozoïques (éocrinoÏdes, cystoïdes, blastoïdes...). Ils correspondent à un type architectural décliné selon de multiples modalités selon les classes ou au sein des classes.
De manière analogue aux bras des crinoïdes, les bras axiaux peuvent être ramifiés. Ces ramifications sont d'ordinaire très nombreuses, mails elles ne s'agencent jamais en une ramure hiérarchisée sur de multiples niveaux comme le sont les bras des crinoïdes. Les ramifications des bras axiaux sont les brachioles. Comme les brachioles présentent la même architecture squelettique que le tronc principal [Sprinkle, 1973], la distinction entre brachioles et bras axiaux est donc purement fonctionnelle. Le tronc principal de chaque bras axial peut s'étendre librement au delà de la thèque, tout en étant ramifié en brachioles ou non (fig.8b-c). Il peut également reposer sur la thèque, façonnant ainsi un second feuillet d'éléments squelettiques plaqués sur la paroi ordinaire extraxiale (fig.8d). Dans ce cas les brachioles demeurent libres, prenant l'aspect d'une chevelure au sommet de la thèque. Cette disposition est notamment celle des cystoïdes rhombifères (fig.2b) et des blastoïdes. Chez ces derniers, il devient possible de proposer une interprétation simple des hydrospires. Jusqu'à présent, les hydrospires des blastoïdes étaient définis comme des cavités tortueuses s'étendant sous les zones ambulacraires, limitées du côté interne par une mince paroi calcaire très contournée et communiquant avec l'extérieur par des pores [Beaver, 1967]. En fait, la paroi interne contournée se révèle être la paroi extraxiale de la thèque. L'ambulacre du blastoïde est un bras axial portant des brachioles et rabattu, mais non plaqué, sur la thèque, dégageant ainsi une petite cavité, l'hydrospire, entre les plaques axiales basales du bras et la thèque (fig.8e). Ceci interdit de considérer que les hydrospires assurent une communication entre milieu externe et intérieur de la thèque [Sprinkle, 1973].
D'autres modalités d'expression, plus dérivées, des bras axiaux s'observent chez les cystoïdes diploporites et chez certains éocrinoïdes.
Phylogenèse
La présentation rapide de trois structures (interambulacres, ceintures marginales et bras) montre que les analyses d'anatomie comparée réalisées à partir du modèle EAT remettent profondément en cause le schéma des homologies pré-existant en entraînent un remaniement sensible de la phylogénie des échinodermes (fig.9). La phylogenèse proposée ici s'appuie sur de très nombreux caractères, mais le schéma présenté ne porte que ceux analysés dans cet article. Elle ne prétend donc pas clarifier la situation de tous les groupes d'échinodermes connus.
Les formes les plus primitives d'échinodermes présentent une architecture du type de celle de Camptostroma (fig.2a) ou de Stromatocystites (fig.6a). Les édrioastéroïdes constituent un clade particulier, mais très proche des formes primitives. La non-homologie entre les anneaux marginaux des édrioastéroïdes et les ceintures des astérides démontrée ci-dessus est un argument complémentaire en faveur de cette solution. Celle-ci correspond à un changement considérable par rapport aux schémas en cours qui considèrent les édrioastéroïdes comme des formes relativement dérivées [Smith, 1984a ; 1988 ; Sumrall, 1997]. Corrélativement, les homalozoaires (parmi lesquels se trouvent les stylophores) deviennent des formes dérivées. Ils constituent en fait un groupement polyphylétique qui pourrait être lié pour partie aux crinoïdes (notamment les stylophores) et pour partie aux cystoïdes et blastoïdes. La topologie envisagée (fig.9) trouve une justification supplémentaire dans la morphologie d'Arkarua (plus ancien fossile considéré comme un échinoderme, infracambrien d'Ediacara) dont l'allure générale rappelle celle de la face orale de Camptostroma ou des édrioastéroïdes. L'hypothèse retenue ici offre également une meilleure congruence avec d'autres données stratigraphiques puisque les plus anciens fossiles attribués à des édrioastéroïdes sont du Cambrien inférieur [Sprinkle & Guensburg, 1997]. L'exploration détaillée de la question de la diversification initiale de ces formes très anciennes est engagée [Mooi & David, 1999].
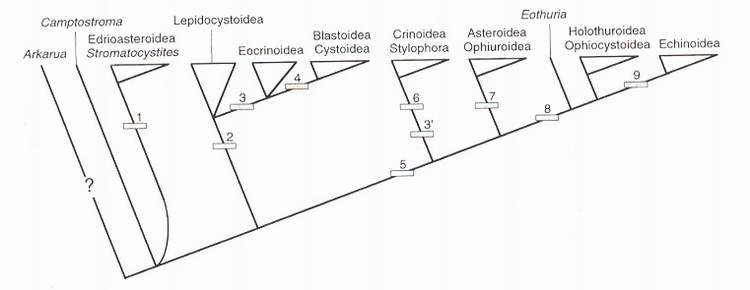
Fig. 9 - Cladogramme des principaux groupes d'échinodermes. Seuls les caractères dont il est question dans le texte sont indiqués, mais la topologie de l'arbre est également fondée sur d'autres caractères. 1, anneau marginal constitué d'éléments extraxiaux imperforés ; 2, bras axiaux et brachioles ; 3 et 3', réduction du squelette extraxial imperforé en une tige ; 4, bras axiaux sur les plaques de la thèque ; 5, bras ; 6, bras digités et pinnules ; 7, ceinture marginale constituée d'éléments extraxiaux perforés ; 8, corps globuleux sans bras ; 9, interambulacres axiaux, appareil apical, réduction du squelette extraxial perforé.
Fig. 9 - Cladogram of the major groups of echinoderms. Only those characters mentioned in the text are indicated, but the topology is based on a number of other characters. 1, marginal ring of imperforate extraxial elements ; 2, axial arms and brachioles ; 3 et "', reduction of extraxial imperforate skeleton into a stem ; 4, axial arms over thecal plates ; 5, arms ; 6, branched arms and pinnules ; 7, marginal ring of perforate extraxial elements ; 8, globose body without arms ; 9, axial interambulacra, apical system, reduction of extraxial perforate skeleton.
La distinction opérée entre bras et bras axiaux conduit à rapprocher les crinoïdes des astérides et des ophiures et à les séparer des cystoïdes et des blastoïdes (fig.9). Les Pelmatozoa ne constituent donc plus un groupe monophylétique et ce terme doit être abandonné. Là encore, la congruence entre le schéma proposé et les données de la stratigraphie est très correct, les crinoïdes (Cambrien moyen, ou plus vraisemblablement Ordovicien si l'on exclut le cas incertain d'Echmatocrinus) et les astérides (Ordovicien) apparaissant plus tardivement que les éocrinoïdes (Cambrien inférieur). L'édification d'un piège à particules ramifié chez les échinodermes se réalise donc selon deux modalités indépendantes : celle des bras axiaux des lépidocystoïdes, cystoïdes et blastoïdes et celle des bras des crinoïdes (et des ophiures gorgonocéphales). La formation d'un système de capture fonctionnel requiert la ramification de l'hydrocoele : la première solution consiste à ne ramifier que le squelette directement lié à ce coelome (bras axiaux), la seconde implique une digitation de l'ensemble du corps (bras).
Les secteurs interradiaux constitués de squelette extraxial perforé, tels qu'ils sont reconnus chez la plupart des échinodermes (figs. 5a et 6), représentent l'état plésiomorphe de l'architecture. A l'opposé, les interambulacres axiaux (fig.2d) sont une autapomorphie des échinides qui apparaissent donc très particuliers. Les formes ordoviciennes globuleuses (comme Eothuria), jusqu'alors classiquement attribuées aux échinides sur la base de leur aspect général [Kier, 1966], ne partagent pas cette apomorphie. Nous ne les considérons ici comme les formes ancestrales du clade qui réunit les échinides, les holothuries et les ophiocystoïdes (fig.9). Si on laisse de côté le cas non déchiffré des Bothriocidaridae, les plus anciens échinides sont alors datés du Silurien.
Une conséquence importante du modèle EAT est que la pentamérie procède directement du développement du squelette axial. Elle est donc moins apparente chez les groupes anciens que chez les groupes dérivés dans lesquels domine la composante axiale. En fait, la pentamérie est une caractéristique dérivée qui se surimpose à la succession extraxial imperforé - extraxial perforé - axial [David & Mooi, 1996 ; 1998]. Mais le choix malencontreux des oursins et des étoiles de mer comme modèles a conduit à ne percevoir les échinodermes que comme des organismes pentaradiés et donc comme un peu à part alors même qu'ils possèdent une organisation fondamentalement linéaire, comparable à celle de bien d'autres organismes, pleinement restituée par le modèle EAT.
Références bibliographiques
AGASSIZ A. (1904) The Panamic deep sea echini. Mem. Mus. Comp. Zool., 31, 1-243.
AGASSIZ L. (1841) Monographies d'échinodermes vivants et fossiles. Echinites, famille des Clypéasteroides, Seconde Monographie, Des Scutelles. Neuchâtel, Suisse, 112p.
BEAVER H.H. (1976) Morphology. In : R.C. MOORE Ed., Treatise on Invertebrate Paleontology, Part S, Echinodermata 1. Geol. Soc. Am. & Univ. Kansas Press, Lawrence, S300-S350.
BEISSWENGER M.(1994) A calcichordate interpretation of the new mitrate Eumitrocystella savilli from the Ordovician of Morocco. Paläont. Z, 68, 443-462.
BOARDMAN R.S., CHEETHAM A.H. & ROWELL A.J. (1987) Fossil invertebrates. Blackwell, Palo Alto (California), 713p.
BOOLOOTIAN R.A. (1966) Physiology of Echinodermata. John Wiley, New York, 822p.
BRUSCA R.C. & BRUSCA G.J. (1990) Invertebrates. Sinauer, Sunderland, 922p.
CRIPPS A.P. (1991) A cladistic analysis of the cornutes stem chordates. Zool. J. Linn. Soc. 102, 333-366.
DAVID B. & MOOI R. (1996) Embryology supports a new theory of skeletal homologies for the phylum Echinodermata. C.R. Acad. Sci., Paris, 319, III, 577-584.
DAVID B. & MOOI R. (1998) Major events in the evolution of echinoderms viewed by the light of embryology. In : R. MOOI & M. TELFORD Eds, Echinoderms San Francisco. Balkema, Rotterdam.
ENAY R. (1993) Palaeontology of invertebrates. Springer-Verlag, Berlin, 287p.
FELL H.B. (1963) The evolution of the echinoderms. Ann. Rep. Smithson. Inst., 1962, 457-490.
FELL H.B. (1965) The early evolution of the Echinozoa. Breviora, 219, 1-17.
GOSSELIN P. & JANGOUX M. (1998) From competent larva to exotrophic juvenile : a morphofunctional study of the perimetamorphic period of Paracentrotus lividus (Echinodermata, Echinoida). Zoomophology, 119, 31-43.
GOULD S.J. (1980) The promise of Paleobiology as a nomothetic, evolutionary discipline. Paleobiology, 6, 96-118.
HART M.W. (1996) Testing cold fusion of phyla : maternity in a tunicate x sea urchin hybrid determined from DNA comparisons. Evolution, 50, 1713-1718.
HYMAN L.H. (1955) The Invertebrates (vol.4) : Echinodermata. McGraw-Hill, New York, 763p.
JACKSON R.T. (1912) Phylogeny of the Echini, with a revision of the Paleozoic species. Boston Soc. Nat. Hist. Mem., 7, 1-490.
JEFFERIES R.P.S. (1967) Some fossil chordates with echinoderm affinities. Symp. Zool. Soc. London, 20, 163-208.
JEFFERIES R.P.S (1981) In defence of the calcichordates. Zool. J. Linnean Soc., 73, 351-396.
JEFFERIES R.P.S (1986) The ancestry of the vertebrates. British Museum (Nat. Hist.) Press, London, 316p.
JEFFERIES R.P.S (1997) How chordates and echinoderms separated from each other and the problem of dorso-ventral inversion. In : J.A. WATERS & C.G. MAPLES Eds, Geobiology of echinoderms. Paleont. Soc. Papers, 3, 249-266.
KESLING R.B. (1967) Cystoids. In : R.C. MOORE Ed., Treatise on Invertebrate Paleontology, Part S, Echinodermata 1. Geol. Soc. Am. & Kansas Press, Lawrence, S85-S267.
KIER P.M. (1966) Noncidaroid Paleozoic Echinoids, In : R.C. MOORE Ed., Treatise on Invertebrate Paleontology, Part U, Echinodermata 3. Geol. Soc. Am & Kansas Press, Lawrence, U298-U312.
KOEHLER R. (1912) Echinodermes (astéries, ophiures et échinides). In : 2è Exped. Antarct. Française 1908-1910. Masosn, Paris, 270p.
LEFEBVRE B., RACHEBOEUF P. & DAVID B. (1998) Homologies in stylophoran echinoderms. In : R. MOOI & M. TELFORD, Eds, Echinoderms San Francisco. Balkema, Rotterdam.
LITTLEWOOD D.T.J., SMITH A.B., CLOUGH K.A. & EMSON R.H. (1997) The interrelationships of the echinoderm classes : morphological and molecular evidence. Biol. J. Linnean Soc., 61, 409-438.
LOWE C.J. & WRAY G.A. (1997) Radical alterations in the roles of homéobox genes during echinoderm evolution. Nature, 389, 718-721.
MARSHALL C.R. (1994) Molecular approaches to echinoderm phylogeny. In : B. DAVID, A. GUILLE, J.P. FERAL & M. ROUX Eds, Echinoderms through time (Echinoderms Dijon), Balkema, Rotterdam, 63-71.
MATSUMURA T. & SHIGEI M. (1988) Collagen biochemistry and the phylogeny of echinoderms. In : C.R.C. PAUL & A.B. SMITH Eds, Echinoderm phylogeny and evolutionary biology. Clarendon Press, Oxford, 43-52.
MOOI R. & DAVID B. (1997) Skeletal homologies of echinoderms. In : J.A. WATERS & C.G. MAPLES Eds, Geobiology of echinoderms. Paleont. Soc. Papers, 3, 305-335.
MOOI R. & DAVID B. (1999) Evolution within a bizarre phylum : the initial radiation of echinoderms. Am. Zool.
MOOI R., DAVID B. & MARCHAND D. (1994) Echinoderm skeletal homologies : Classical morphology meets modern phylogenetics. In : B. DAVID, A. GUILLE, J.P. FERAL & ROUX Eds, Echinoderms through time (Echinoderms Dijon). Balkema, Rotterdam, 87-95.
PARSLEY R.L. (1991) Review of selected north American mitrate stylophorans (Homalozoa, Echinodermata). Bull. Am. Paleont., 100, 5-54.
PARSLEY R.L. (1997) the echinoderm classes Stylophora and Homoiostelea : non Calcichordata. In : J.A. WATERS & C.G. MAPLES Eds, Geobiology of echinoderms. Paleont. Soc. Papers, 3, 225-248.
PAUL C.R.C. & SMITH A.B. (1984) The early radiation and phylogeny of echinoderms. Bio. Rev., 49, 443-481.
PEARSE V.B. & PEARSE J.S. (1994) Echinoderm phylogeny and the place of concentricycloids. In : B. DAVID, A. GUILLE, J.P. FERAL & M. ROUX Eds, Echinoderms through time (Echinoderms Dijon). Balkema, Rotterdam, 121-126.
PETERSON K.J. (1995) A phylogenetic test of the calcichordate scenatio. Lethaia, 28, 25-38.
SMILEY S. (1988) The phylogenetic relationship of holothurians : a cladistic analysis of the extant echinoderm classes. In : C.R.C. PAUL & A.B. SMITH Eds, Echinoderm phylogeny and evolutionary biology. Clarendon Press, Oxford, 69-84.
SMITH A.B. (1984a) Classification of the Echinodermata. Palaeontology, 27, 431-459.
SMITH A.B. (1984b) Echinoid Paleobiology. Allen and Unwin, London, 190p.
SMITH A.B. (1988) Patterns of diversification and extinction in early Palaeozoic echinoderms. Palaontology, 31, 799-828.
SMITH A.B. (1990) Evolutionary diversification of echinoderms during the early Palaeozoic. In : P.D. TAYLOR& G.P. LARWOOD Eds, Major evolutionary radiations. Clarendon Press, Oxford, 265-286.
SMITH A.B. (1992) Echinoderm phylogeny, morphology and molecules approach accord. Trends Ecol. Evol., 7, 224-229.
SMITH A.B. & JELL P.A. (1990) Cambrian edrioasteroids from Australia and the origin of starfishes. Mem. Queensland Mus., 28, 715-778.
SPENCER W.K. & WRIGHT C.W. (1966) Asterozoans. In : R.C. MOORE Ed., Treatise on Invertebrate Paleontology, Part U, Echinodermata 3. Geol. Soc. Am. & Univ. Kansas Press, Lawrence, U4-U107.
SRPINKLE J. (1973) Morphology and evolution of blastozoan echinoderms. Mus. Comp. Zool. Spec. Publ., Cambridge, 284p.
SPRINKLE J. & GUINSBURG T.E. (1997) Early radiation of echinoderms. In : J.A. WATERS & C.G. MAPLES Eds, Geobiology of echinoderms. Paleont. Soc. Papers, 3, 205-224.
STRATHMANN R.R. (1988) Larvae, phylogeny, and von Baer's Law. In : C.R.C. PAUL & A.B. SMITH Eds, Echinoderm phylogeny and evolutionary biology. Clarendon Press, Oxford, 53-68.
SUMRALL C.D. (1997) The role of fossils in the phylogenetic reconstruction of Echinodermata. In : J.A. WATERS & C.G. MAPLES Eds., Geobiology of echinoderms. Paleont. Soc. Papers, 3, 205-224.
SUMRALL C.D. & SPRINKLE J. (1998) Phylogenetic analysis of living Echinodermata based on primitive fossil taxa. In : R. MOOI & M. TELFORD Eds, Echinoderms San Francisco. Balkema, Rotterdam.
UBAGHS G. (1967a) General characters of Echinodermata. In : R.C. MOORE Ed., Treatise on Invertebrate Paleontology, Part S, Echinodermata 1. Geol. Soc. Am & Univ. Kansas Press, Lawrence, S3-S60.
UBAGHS G. (1967b) Stylophora.. In : R.C. MOORE Ed., Treatise on Invertebrate Paleontology, Part S, Echinodermata 1. Geol. Soc. Am & Univ. Kansas Press, Lawrence, S495-S565.
WILLIAMSON D.I. (1992) Larvae and evolution. Toward a new zoology. Chapman & Hall, New York, 223p.
WOODS L.S. & JEFFERIES R.P.S. (1992) A new stem group chordate from the Lower Ordovician of South Wales, and the problem of locomotion in boot-shaped cornutes. Palaeontology, 35, 1-25.
(1) UMR CNRS 5561 BIOGEOSCIENCES, Université de Bourgogne, 6 bd Gabriel, 21000 Dijon, France
(2) Department of Invertebrate Zoology and Geology, California Academy of Sciences, Golden Gate Park, San Francisco, CA 94118-5699, USA;
Cet article fait partie du Bulletin de la Société Géologique de France, 1999, t.170, n°1, pp.91-101 et a été déposé le 15 janvier 1998 ; accepté après modifications le 21 juillet 1998.